2. 海德热带农业资源研究所, 三亚, 572025
3. 广西大学生命科学与技术学院, 南宁, 530005
* 同等贡献作者
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 21 篇 doi: 10.5376/gab.cn.2011.30.0021
收稿日期: 2010年12月28日 接受日期: 2011年04月21日 发表日期: 2011年05月05日
引用格式(中文):
柳参奎等, 2011,Bt Cry1Ac22 杀虫蛋白在酿酒酵母中表达和亚细胞定位,基因组学与应用生物学(online), Vol.30 No.21 pp.1133-1138 (doi: 10.5376/gab.cn.2011.30.0021)
引用格式(英文):
Liu et al., 2010, Expression and Localization of Cry1Ac22 Crystal Protein from Bacillus thuringiensis W015-1 in Yeast (Saccharomyces cerevisiae), Bt Research (online), Vol.1 No.2 (DOI: 10.5376/bt.2010.01.0002)
为了弄清Bt Cry1Ac22杀虫晶体蛋白在真核中的表达与亚细胞定位,我们以载体pYES2为基础,将cry1Ac22杀虫基因和绿色荧光蛋白GFP基因融合,构建含Cry1Ac22毒蛋白和绿色荧光蛋白(GFP)的真核表达载体pYES2-Cry1Ac22-GFP。该融合基因以酵母GAL1启动子启动,经20%半乳糖大量诱导Cry1Ac22-GFP融合蛋白表达,在酵母细胞中呈点状聚集, SDS-PAGE检测表明在转化入pYES2-Cry1Ac22-GFP的菌液的粗蛋白中,表达一条新的蛋白条带,分子量约130 kD左右。在荧光显微镜下观察,显示Cry1Ac22-EGFP融合蛋白在酵母细胞膜上能够发出强烈荧光,表明cry1Ac22基因定位在酵母细胞膜上,与其蛋白跨膜结构预测相一致。本研究为Bt杀虫蛋白的功能研究及追踪转基因目标蛋白的踪迹提供思路和方法。
苏云金芽孢杆菌(Bacillus thuringiensis, 简称Bt)是一种在芽孢形成时能生产伴孢晶体蛋白的革兰氏阳性细菌,由于伴孢晶体蛋白对一些农业害虫有毒杀作用而越来越受到关注(Li et al., 1991; Knowles and Ellar, 1986)。Cry1Ac22毒素是一个从僵死幼蚕的肠道中分离出来的Bt菌株W015-1中分离的杀虫晶体蛋白。该菌株对豆天蛾(Clanis bilineata Walker)、棉铃虫(Helicoverpa armigera)、斜纹夜蛾(Spodoptera litura)、小菜蛾(Plutella xylostella)等鳞翅目昆虫表现出比HD73具有更高的杀虫活性(Xie et al., 2010)。
cry1Ac22基因编码1 178个氨基酸残基的蛋白质,与从HD73中克隆的cry1Ac1基因氨基酸序列在233 (T/R)、448 (M/I)和1 158 (K/E) 3个位点不同(Adang et al., 1985; Xie et al., 2010)。cry1Ac22基因在大肠杆菌中能够大量表达133 kD包涵蛋白,纯化的蛋白对小菜蛾(Plutella xylostella)表现出较高的杀虫活性(Xie et al., 2010; Liu et al., 2010)。基于W015-1来源于从僵死幼蚕的肠道中,而且其cry基因型与HD73有明显的多样性,因此,W015-1菌株及其杀虫蛋白可做为农业害虫综合防治及抗性管理的候选菌株。
弄清Cry1Ac22在真核细胞中的表达与定位,对深入研究该基因在高等植物中的表达具有重要的价值。本研究以来自水母(Aequrea victoria)的绿色荧光蛋白(Green fluorescent protein, GFP)作为报告分子,构建了GFP标记的Cry1Ac22融合蛋白,初步研究了该融合蛋白在酿酒酵母的表达与细胞定位分布,以期为进一步利用该基因进行转基因植物研究提供理论依据。
1结果与分析
1.1 pGFP-Cry1Ac22载体的构建及鉴定
本研究中,GFP基因来自于哺乳动物表达载体pGFP。通过酶切连接方法,在线性载体两端引入BamHІ和KpnІ识别位点。对cry1Ac22基因进行序列分析,根据cry1Ac22基因序列设计引物,构建cry1Ac22基因的TA克隆载体。采用BamHІ和KpnІ酶切重组质粒pMD18-T-Cry1Ac22获得一条长为2 178 bp的基因片段(图1B),采用BamHⅠ和KpnⅠ酶切pGFP载体,获得3 400 bp的pGFP线性片段(图1A),回收目的片段,16℃连接并转化JM109感受态细胞。采用BamHⅠ和KpnⅠ酶切重组子鉴定筛选阳性克隆(图2),1、2、3、4、5、6、7、9、10号泳道均获得一条2 178 bp长的Cry1Ac22目的片段和一条长3 400 bp的pGFP载体片段,为阳性重组子,表明pGFP-Cry1Ac22载体构建成功。
.png) 图1 BamHⅠ和KpnⅠ酶切pGFP (A)载体和pMD18-T-Cry1Ac22载体(B) |
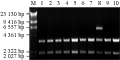 图2 BamHⅠ和KpnⅠ酶切鉴定重组子 |
1.2 pYES2-Cry1Ac22-GFP酵母表达载体的构建及鉴定
采用BamHⅠ和NotⅠ酶切筛选的阳性克隆质粒获得一条由cry1Ac22基因和GFP基因组成的融合基因,长约为3 000 bp的基因片段(图3),同时采用BamHⅠ和NotⅠ酶切pYES2载体,获得一条长5.9 kb的pYES2载体片段(图3),回收目的片段,16℃连接转化JM109感受态细胞。挑取重组子进行BamHⅠ和NotⅠ酶切验证,均获得一条3 000 bp长的目的基因片段和一条长5.9 kb的pYES2载体片段(图4),鉴定表明图中1、2、3、4号泳道均为阳性重组子,说明酵母表达载体pYES2-Cry1Ac22-EGFP构建成功。
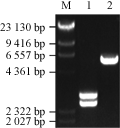 图3 pGFP-Cry1Ac22和pYES2载体的BamHⅠ和NotⅠ酶切图 |
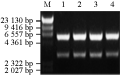 图4 YES2-Cry1Ac22-GFP酵母表达载体的BamHⅠ和NotⅠ酶切验证 |
1.3 pYES2-Cry1Ac22-GFP载体的转化研究
为研究pYES2载体中Cry1Ac22-GFP的表达及定位情况,对该载体进行了酵母的转化研究。GFP报告基因融合了苏云金芽孢杆菌Cry1Ac22杀虫晶体蛋白,转入酵母后GFP-Cry1Ac22蛋白应该在酵母中表达。将pYES2-Cry1Ac22-GFP载体转入酿酒酵母INVScl菌株,荧光显微镜观察,荧光呈点状聚集(图5),显示Cry1Ac22-GFP蛋白在酵母细胞中能够表达。
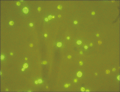 图5低倍显微镜下酵母荧光融合蛋白表达 |
1.4 cry1Ac22-EGFP融合基因在酵母中表达
收集不同时期经半乳糖诱导的重组酵母菌液,采用SDS-PAGE检测。由电泳图谱(图6)可见,在转化入pYES2-Cry1Ac22-GFP的菌液的粗蛋白中,发现一条新的蛋白条带,分子量约130 kD左右,而未经半乳糖诱导的菌液粗蛋白中未见此条带(1号泳道)。结果初步表明, 重组质粒pYES2-Cry1Ac22-GFP在半乳糖的诱导下,产生了融合蛋白Cry1Ac22-GFP,并得以高效表达;随着诱导时间的延长,融合蛋白的表达量稳定。
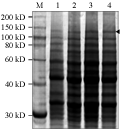 图6 Cry1Ac22-GFP融合蛋白在酵母中诱导表达 |
1.5 cry1Ac22基因在酵母细胞中的定位
将构建好的融合有GFP报告基因的Cry1Ac22功能结构域的pYES2-Cry1Ac22-GFP质粒转化至酵母细胞中,半乳糖诱导培养制片,于激光共聚焦显微镜下直接观察发现。含pYES2-Cry1Ac22-GFP质粒的重组酵母在诱导12 h后,在倒置荧光显微镜下观察可见有绿色荧光的酵母细胞约占细胞总数的60%。在含pYES2-GFP空载体的酵母中,荧光蛋白在全细胞中呈弥散样分布(图7A), 而pYES2-Cry1Ac22-GFP定位于质膜,胞浆中也有表达,但不存在于细胞核内(图7B)。cry1Ac22基因N端的结构域Ⅰ为一组由6~7个两亲的α螺旋围绕着一个疏水的α螺旋形成的α螺旋束,是疏水的部分,是发挥特异毒力的功能区域,参与了细胞膜的穿孔。实验结果与其结构特点和定位预测相一致。
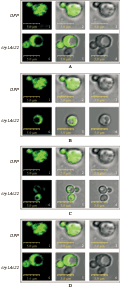 图7 Cry1Ac22蛋白在酵母中荧光定位 |
2讨论
本研究采用的pYES2 (5 900 bp)为酵母-大肠杆菌多拷贝的穿梭质粒,可分别在S. cerevisiae及E. coli中自主复制,是T7启动子控制下的分泌型表达载体。重组质粒在多克隆插入时,可通过LacZ基因的插入失活来进行蓝白筛选,同时含有Amp抗性基因。
pYES2含有酵母URA基因,是营养缺陷型的筛选标记。以营养缺陷型酿酒酵母作为模型生物,成功构建了含报告基因-增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因的大肠杆菌-酿酒酵母穿梭载体pYES2-Cry1Ac22-EGFP(Misteli and Spector, 1997)。在大肠杆菌中复制,在酿酒酵母中表达,Cry1Ac22-EGFP在同一阅读基因框中,形成融合蛋白。EGFP蛋白在紫外光的激发下可显示绿色荧光,该基因与目的基因连接不会影响目的基因的表达,而且能与目的基因形成融合蛋白,较好的标示基因的表达情况。
重组质粒转化营养缺陷型酿酒酵母INVScl后,在荧光显微镜下观察不同时间酵母的表达情况,若能在细胞内复制就会表达EGFP,在紫外光激发下发出绿色荧光。结果表明,转化的酵母在荧光显微镜下观察到绿色荧光,在诱导表达12 h后荧光最强,未经转染的酵母不发荧光。
构建了绿色荧光蛋白GFP标记的Cry1Ac22融合蛋白,研究该融合蛋白在酿酒酵母的表达与定位分布,为Bt杀虫相关蛋白的功能研究提供理论依据,同时可作为示踪转基因蛋白的轨迹提供很好的研究。
3材料与方法
3. 1质粒和菌种
供试实验菌株和质粒、载体均为海德热带农业资源研究所,保存(表1)。
| 表1供试菌株和质粒 |
3.2培养基
酵母生长所用培养基为SD:酵母氮碱0.67%,葡萄糖2.00%,缺尿嘧啶的氨基酸省却混合物 0.13%;再诱导培养液SC (酵母氮碱0.67%, 半乳糖2.00%, 缺尿嘧啶的氨基酸省却混合物0.13%)中培养以诱导GFP的表达。E. coli培养基均使用LB培养基,参照文献(Sambrook et al., 2002)。
3.3试剂和仪器
无氨基酸酵母氮源(yeast nitrogen base)为Difco公司产品;各种限制性内切酶、Taq DNA聚合酶、变性鲑精单链辅助DNA、dNTP购自TaKaRa公司;溶菌酶、RNaseA、DNA琼脂糖凝胶回收试剂盒、DNA Marker、EDTA购自Tiangen公司,T4 DNA连接酶购自Promega公司;琼脂糖购自宝泰克公司,各种氨基酸、DMSO、PEG3350、棉子糖、半乳糖为Amresco公司产品;Tris (pH 8.0)饱和的苯酚、氯仿等试剂均为国产分析纯。PCR仪为ABI 9600。垂直板电泳仪为美国Bio-Rad公司产品。Olympus BX50显微镜用于荧光观察。
3.4重组质粒pGFP-Cry1Ac22的构建
取pGFP载体和构建完整的pMD18-T-Cry1Ac22载体进行BamHⅠ、KpnⅠ酶切。将上述两个酶切产物分别经1.0%琼脂糖凝胶电泳分离后,用DNA琼脂糖凝胶回收试剂盒回收目的片段,目的片段和载体16℃连接过夜。在冰上解冻E. coli JM109感受态细胞,取4 μL连接反应产物加入感受态细胞中,轻弹管壁,使其均匀分布,置冰上30 min, 42℃热休克90 s,加入LB培养基400 μL,37℃振荡培养1 h,取100 μL转化液铺于含100 μg/mL氨苄青霉素的LB筛选平板上,置37℃过夜培养,煮沸法提取单菌落质粒,酶切鉴定阳性克隆。
3.5重组质粒pYES2-Cry1Ac22-EGFP的构建
将鉴定正确的pGFP-Cry1Ac22阳性质粒和pYES2载体用限制性内切酶BamHⅠ和NotⅠ于37℃双酶切3 h,将上述两个酶切产物分别经1.0%琼脂糖凝胶电泳分离后,用DNA琼脂糖凝胶回收试剂盒回收目的片段,两个酶切片段经T4 DNA 连接酶于4℃连接过夜。连接产物转化进E. coli JM109感受态细胞,选取阳性菌落扩繁并进行重组质粒提取,双酶切鉴定阳性克隆。
3.6重组质粒pYES2-Cry1Ac22-EGFP转化酿酒酵母
采用Invitrogen公司提供的LiAc/SS2DNA/PEG法制作酿酒酵母感受态细胞。取500 μL感受态细胞加入100 μL Buffer1、1~2 μg鉴定正确的重组质粒和2 μL鲑精DNA,轻微混匀;加入600 μL Buffer2至离心管中,温柔混匀,30℃振荡30 min;加入70 μL DMSO至离心管中,42℃热激15 min;轻微离心10 s,采用TE Buffer洗涤沉淀,加入300~500 μL TE Buffer 30℃培养30 min;涂布平板至SD-ura平板上,30℃培养3 d,单菌落即为转化重组子;挑取单菌落在显微镜下镜检观察并进一步验证其正确性。
3.7重组质粒在酿酒酵母中的诱导表达
将酵母阳性克隆接种到含棉子糖1%的SC-U液体培养基中,于30℃,170 r/min下过夜培养。培养物于4℃,12 000 r/min离心5 min,菌体用含半乳糖2% SC-U液体培养基重悬细胞沉淀,使OD600为0.4。置30℃,170 r/min下培养。收集半乳糖诱导培养6 h、12 h、24 h的菌液,采用液氮研磨充分后,收集上清液制备成SDS-PAGE上样液,10%聚丙烯酰胺凝胶电泳检测。
3.8 cry1Ac22基因在酵母细胞中的定位
从平板上挑取单菌落到液体SC选择培养基中,30℃培养过夜,取1/2菌液,水洗3次,转到SC诱导培养基(以20%的半乳糖代替葡萄糖为唯一碳源)中,继续培养20 h。收集诱导和未诱导的菌体,水洗3次,加入等体积2%的低熔点琼脂糖,混匀,加到50℃预热的载玻片上,封片,暗处放置5 min,在荧光显微镜下镜检,拍照。
作者贡献
柳参奎、刘卓明是本研究的实验设计和实验研究执行人;李有志参与实验设计,试验结果分析;方宣钧是项目的负责人,指导实验设计,数据分析,论文修改和写作。全体作者都阅读并同意最终的文本。
致谢
本研究受中国Bt收集与鉴定项目的资助。作者感谢东北林业大学盐碱地资源环境中心张欣欣博士、海德热带农业资源研究所张文飞、谢柳先生在本实验过程中的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Adang M.J., Staver M.J., Rocheleau T.A., Leighton J., Barker R.F., and Thompson D.V., 1985, Characterized full-length and truncated plasmid clones of the crystal protein of Bacillus thuringiensis subsp. kurstaki HD-73 and their toxicity to Manduca sexta, Gene, 36(3): 289-300 doi:10.1016/0378-1119(85)90184-2
Knowles B.H., and Ellar D.J., 1986, Characterization and partial purification of a plasma membrane receptor for Bacillus thuringiensis δ-endotoxin with different insect specificity, Biochimica et Biophysica Acta, 924: 509-518
Li J., Carrol J., and Ellar D.J., 1991, Crystal structure of insecticidal δ-endotoxin from Bacillus thuringiensis at 2.5Å resolution, Nature, 353(6347): 815-821 doi:10.1038/353815a0 PMid:1658659
Liu Z.M., Liu S.K., Li Y.Z., and Fang X.J., 2010, Heterologous expression and purification of Cry1ac22 toxin from Bacillus thuringiensis W015-1, Bioscience Methods, Vol.1 No.2 (DOI:10.5376/bm.2010.01.0002)
Misteli T., and Spector D.L., 1997, Applications of the green fluorescent protein in cell biology and biotechnology, Nat Biotechnol, 15(10): 961-964 doi:10.1038/nbt1097-961 PMid:9335045
Sambrook J.E., Fritsch F., and Maaiatis T., 2002, Experiment guidance of Molecular clone, Science press, Beijing, China, pp.483-485
Xie L., Zhang W.F., Liu Z.M., Cai Y.G., Li Y.Z., and Fang X.J., 2010, Characterization of a new highly toxic isolate of Bacillus thuringiensis from the diapausing larvae of silkworm and identification of cry1A 22 gene, Bt Research (online), Vol.1 No.1 (DOI: 10.5376/bt.2010.01.0001)